La mayoría de personas conocemos, aunque sea por encima, cuál es el papel que tienen las plaquetas en el organismo: son células sanguíneas que se movilizan cuando se produce una lesión en los vasos sanguíneos, formando un tapón plaquetario que ayuda a detener el sangrado. Este proceso, conocido como coagulación, es vital para mantener la integridad del sistema circulatorio y evitar hemorragias internas.1
Más allá de esta noción, el conocimiento que tenía de estas pequeñas células hasta hace unos días no era mucho más profundo. Ni el número que debíamos tener en sangre, ni cómo se producían ni su tiempo de vida. De pequeño había estado familiarizado con ellas porque a mi hermano le diagnosticaron enfermedad de Von Willebrand, un trastorno de origen genético que afecta a la coagulación y que se caracteriza por tener niveles muy bajos de factor de von Willebrand —una proteína que circula por la sangre y que también está presente en los vasos sanguíneos, de tal manera que, cuando se produce un sangrado, este factor queda expuesto y permite a las plaquetas adherirse para iniciar la coagulación—. Sin este factor, la coagulación apenas se produce. Esta enfermedad debe su nombre al hematólogo Eric von Willebrand, quien en 1924 describió el caso de una familia de las islas de Åland que tenía problemas de coagulación.2,3 A pesar de que me tocaba de cerca, la biología de las plaquetas era un misterio para mí. Quizá uno no empieza a interiorizar las cosas hasta que realmente le tocan a uno mismo.
El pasado lunes 6 de mayo (de 2024) me desperté con manchas de sangre en la lengua y los labios. Llevaba varios días con fiebre y gastroenteritis, así que pensé que quizá estaba empeorando y decidí ir a urgencias. Ver pequeños sangrados en partes visibles de tu cuerpo no hace más que poner la imaginación en funcionamiento, lo que lleva a preguntarte qué estará ocurriendo en aquellos lugares que no puedes ver. De urgencias del centro de atención primaria me derivaron directamente a urgencias del hospital Sant Pau de Barcelona. Además de los sangrados más visibles, tenía múltiples puntitos del tamaño de la cabeza de un alfiler por piernas, abdomen y cuello, lo que se conocen como petequias. Pidieron diferentes pruebas, entre ellas análisis de sangre, y mientras estaba esperando tumbado en una camilla haciendo planes en mi cabeza para esa misma tarde, vino la doctora que me había atendido y me dijo que mi recuento de plaquetas era de 1.000 por microlitro. Por su expresión y por la frase que vino después intuí que eran muy pocas. “Hoy, mañana, pasado, y veremos si los siguientes días, tendrás que pasarlos ingresado en hematología. Si el umbral mínimo son 150.000 plaquetas por microlitro, ahora tienes un recuento de 1.000”.
¿Cómo mi cuerpo pudo quedarse con tan pocas plaquetas? ¿Era un problema de que mi médula ósea no podía producirlas o había otra causa? En ese momento, por descarte y tras valorar todas las pruebas que me habían hecho, el diagnóstico que me dieron fue púrpura trombocitopénica idiopática (conocida comúnmente como trombocitopenia inmune o PTI por sus siglas). La infección que me había tenido en cama la semana anterior había producido presumiblemente una reacción autoinmune que había provocado que mi sistema inmunitario acabara con la mayoría de plaquetas de mi cuerpo.
Mi cuerpo era capaz de generar nuevas plaquetas, pero mi sistema inmunitario, sin causa aparente, las eliminaba. Antes de nada, ¿cómo se generan las plaquetas? Estas células se producen principalmente en la médula ósea a partir de la diferenciación de las células madre hematopoyéticas en megacariocitos. Estas células son muy especiales, ya que, en lugar de tener un solo núcleo simple, poseen un gran núcleo lobulado con múltiples copias del material genético. Esto hace que los megacariocitos sean células excepcionalmente grandes, con un diámetro de 50 a 100 μm, en comparación, por ejemplo, con los monocitos —las células progenitoras de los macrófagos— que miden alrededor de 12 a 20 μm. Llegado el momento de maduración, en una especie de explosión controlada, pueden derivar en más de un millar de plaquetas que terminan recorriendo la sangre, asegurando la estabilidad en la circulación sanguínea (Figura 1).1 Además, actualmente se ha descrito que esta producción de las plaquetas no sucede únicamente en la médula. Un estudio publicado en Nature reveló que los megacariocitos viajan desde la médula ósea hasta los pulmones, pudiendo representar aproximadamente el 50% de la biogénesis total de plaquetas, lo cual equivale a alrededor de 10 millones de plaquetas por hora.4

Figura 1. Diferenciación de células madre en la médula ósea. Proceso en el que las células madre multipotentes de la médula ósea se diferencian en tipos celulares específicos como glóbulos rojos, blancos y plaquetas, esencial para mantener la población sanguínea del cuerpo.
En un transcurso normal en la vida de las plaquetas, estas pueden circular en la sangre durante 7-10 días para después ser eliminadas en el bazo o en el hígado.1 ¿Cómo el sistema inmune puede eliminar sin ningún tipo de causa aparente unas células que son fundamentales para la vida? El cuerpo es un milagro de la naturaleza que funciona casi como una máquina perfecta. No obstante, en muy raras ocasiones puede fallar. Esto hace que la incidencia de una enfermedad autoinmune como la PTI entre la población sea muy baja, de tan solo 2-4 casos por cada 100.000 personas al año. Aunque algunos pacientes tienen un episodio de PTI seguido de una remisión inmediata, la PTI se desarrolla de forma crónica en hasta el 70% de los adultos con esta condición.5
Nuestro sistema inmunitario está altamente regulado para protegernos de bacterias, virus y células premalignas con el fin de preservar la salud y prevenir enfermedades como el cáncer. En muy raras ocasiones falla. La primera vez que se tuvo constancia de que el sistema inmunitario podía eliminar por error a las plaquetas fue en un experimento muy audaz llevado a cabo por el hematólogo Dr. William Harrington en 1951.6 Intrigado por los casos de pacientes que sufrían hemorragias severas sin una causa clara, Harrington se infundió plasma de un paciente con PTI, prediciendo que si el plasma contenía algún factor que afectara a las plaquetas, él mismo experimentaría síntomas similares. Efectivamente, poco después de la infusión, su número de plaquetas disminuyó drásticamente, sugiriendo que el sistema inmunitario de los pacientes con PTI estaba produciendo autoanticuerpos que erróneamente eliminaban sus propias plaquetas.
¿Por qué el sistema inmunitario puede destruir las plaquetas?
Si bien las causas todavía no están claras, actualmente se conocen algunos de los mecanismos implicados en la destrucción de las plaquetas por parte del sistema inmunitario. Uno de estos mecanismos involucra a los autoanticuerpos producidos por células B, un tipo de linfocito especializado en la generación de anticuerpos que normalmente combaten a virus y bacterias. En el caso de la PTI, estos autoanticuerpos se dirigen erróneamente contra las plaquetas. Este comportamiento autorreactivo de las células B puede ser desencadenado por infecciones virales que alteran la regulación inmunitaria (como la que pude llegar a tener), o por una predisposición genética que interfiere con la tolerancia inmune.
Una vez que los autoanticuerpos se unen a las plaquetas, las marcan para su destrucción. Este marcaje facilita el reconocimiento de las plaquetas por parte de los macrófagos en el bazo y el hígado, que las fagocitan y destruyen. Por ello, en algunos casos en los que los primeros tratamientos propuestos no funcionan, se propone la extirpación del bazo (esplenectomía), ya que además de ser un órgano en el que se eliminan las plaquetas, también juega un papel en la producción de autoanticuerpos que atacan a las plaquetas.5,7
Por otro lado, los autoanticuerpos afectan igualmente a la biogénesis de las plaquetas atacando a los megacariocitos, interfiriendo en su capacidad para producir nuevas células disminuyendo el número total de plaquetas en la circulación. Los fragmentos de las plaquetas destruidas son expuestos por células presentadoras de antígeno a través del complejo mayor de histocompatibilidad de clase II a los linfocitos T, lo que puede estimular respuestas inmunitarias adicionales contra las plaquetas y perpetuar el ciclo de autoinmunidad. Este tipo de linfocitos, que en un contexto por ejemplo de cáncer se dedican a atacar a las células tumorales, en una PTI eliminan las plaquetas.8 La activación continua de estas células T puede llevar a un desequilibrio en los subtipos de células T, promoviendo un aumento en células proinflamatorias como las Th1 y Th17, y una reducción en las células T reguladoras, que son las encargadas de suprimir la función inflamatoria para evitar ataques autoinmunes, exacerbando aún más la destrucción de plaquetas. Se crea una tormenta perfecta que destruye las plaquetas sin una causa aparente (Figura 2).
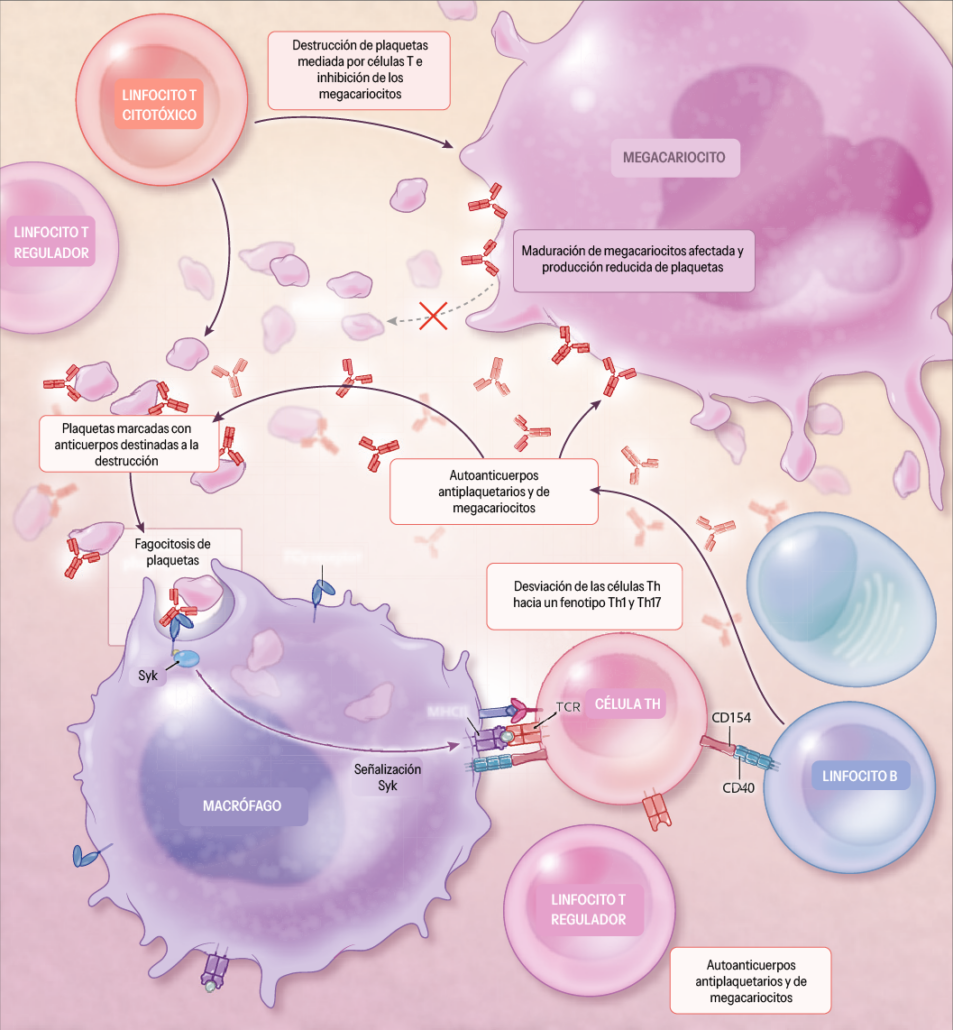
Figura 2. Mecanismos implicados en la trombocitopenia inmune. Adaptada de Cooper et al. New England Journal of Medicine, 2019.5
Debido a que el sistema inmune está desbocado, el tratamiento con glucocorticoides es la terapia inicial estándar para pacientes con PTI principalmente por su potente efecto antiinflamatorio e inmunosupresor. Aunque entre el 60 y el 80% de estos pacientes muestran una respuesta inicial a los glucocorticoides, solo entre el 30 y el 50% de los adultos tienen una respuesta sostenida después de que se suspendan los glucocorticoides.5,9
En mi caso el tratamiento funcionaba en esta primera fase. Entré el lunes con 1.000 plaquetas por microlitro de sangre, el recuento del martes era 2.000, el miércoles 20.000, y el jueves 40.000. Aun estando muy por debajo del umbral mínimo, los glucocorticoides estaban consiguiendo aumentar las plaquetas en sangre. Aunque todavía no sabemos si seré parte de ese 70% de personas cuyo episodio de PTI se convierte en crónico, el riesgo de sangrado interno estaba disminuyendo.
Dios no juega a los dados, ¿o sí?
Muchas veces escuchamos eso de que la vida te cambia en un segundo. Vas al médico pensando que te va a dar un tratamiento para una simple gripe y terminas durmiendo en el hospital compartiendo planta con pacientes con enfermedades como la leucemia. Mi episodio solo ha sido una llamada de atención y no es comparable a lo que sufren aquellas personas que verdaderamente no saben si van a poder sobrevivir a la enfermedad. No obstante, cada uno en su situación se hace muchas preguntas casi siempre sin respuesta: ¿por qué a mí?, ¿por qué en cuestión de horas mi sangre se ha quedado sin plaquetas convirtiendo a mi cuerpo en una bomba de relojería?, ¿volverá a pasarme?
Mi compañero de habitación, médico de formación, con una enfermedad grave por delante, siempre con buen gesto y un ¿qué tal estás hoy Adrián?, me dijo en una de nuestras primeras conversaciones que en la vida (y en la enfermedad) el azar es un elemento impredecible que puede cambiar la realidad sin motivo aparente. No todo lo que nos sucede tiene una causa. Albert Einstein, padre de la física moderna, se mostraba reticente a aceptar el principio de incertidumbre y el azar en el mundo cuántico, prefería pensar que “Dios no juega a los dados con el universo”. Sin embargo, la historia ha demostrado que el azar juega un papel mucho más determinante de lo que quisiéramos admitir. En nuestro mundo, muchas enfermedades crónicas que nos afligen hoy, como las cardiovasculares o algunos tipos de cáncer, están relacionadas con nuestro estilo de vida actual y la exposición a agentes contaminantes. Otras, simplemente se deben al azar.
Suscríbete para disfrutar de todo el contenido.
Regálate Fissac
con un 50% el primer año
Aprovecha un 50% de descuento el primer año. En lugar de 69,99€, pagas 34,99€ (2,9€/mes). Regálate ciencia.
Sumérgete en la profundidad de Fissac y disfruta de todo lo que tenemos para ofrecerte. Suscríbete ahora y aprende con rigor científico con los audio-artículos, webinars, masterclass y Fissac Magazine
Cancela tu suscripción cuando quieras sin compromiso. Oferta para una suscripción anual de Fissac; solo disponible para nuevos suscriptores. Para una suscripción mensual, se cobrará automáticamente por adelantado a su método de pago la tarifa de 7,00€ cada mes. Para una suscripción anual, se cobrará automáticamente por adelantado a su método de pago la tarifa introductoria de 34,99€ el primer año y 69,99€ el resto. Su suscripción continuará hasta que la cancele. La cancelación entra en vigencia al final de su período de facturación actual. Impuestos incluidos en el precio de la suscripción. Los términos de la oferta están sujetos a cambios.
En esos momentos de incertidumbre, la única certeza que hizo sentirme seguro y protegido fue el propio sistema sanitario, la sanidad pública. La planta de oncohematología en la que muchas personas combaten enfermedades en equilibrio con la vida se convirtió en un espacio de tranquilidad. Puede sonar a mantra, pero la Sanidad en España es un privilegio del que no somos conscientes. Y que mira a todos por igual. En esa vorágine de personas y estrés todo funciona a la perfección. Y siempre con buenas caras. Cuando ves tu vida pasar, la protección de médicos, enfermeros, celadores y personal de limpieza es tan efectiva que incluso en esos momentos en los que no sabes qué va a pasar, te sientes seguro. La sanidad pública es el elemento central sobre el que debe pivotar un país que cuida a sus ciudadanos. Y hay que defenderla.
¿Qué te puede ocurrir en un país como Estados Unidos sin un estado de bienestar público y universal? En un mundo que apela cada vez más al individualismo, en el que las desigualdades sociales parecen abrirse paso, son en esos momentos en el que la salud te da la espalda de forma azarosa cuando te das cuenta de que como seres humanos necesitamos del otro para poder seguir viviendo.
Referencias:
1. van der Meijden PEJ, Heemskerk JWM. Platelet biology and functions: new concepts and clinical perspectives. Nat Rev Cardiol. 2019;16(3):166-179. doi:10.1038/s41569-018-0110-0
2. Mukherjee S. The Song of the Cell: An Exploration of Medicine and the New Human. Simon and Schuster; 2022.
3. Nilsson IM. The history of von Willebrand disease. Haemophilia. 1999;5(s2):7-11. doi:https://doi.org/10.1046/j.1365-2516.1999.0050s2007.x
4. Lefrançais E, Ortiz-Muñoz G, Caudrillier A, et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 2017;544(7648):105-109. doi:10.1038/nature21706
5. Nichola C, Waleed G. Immune Thrombocytopenia. New England Journal of Medicine. 2019;381(10):945-955. doi:10.1056/NEJMcp1810479
6. Harrington WJ, Minnich V, Hollingsworth JW, Moore C V. Demonstration of a thrombocytopenic factor in the blood of patients with thrombocytopenic purpura. J Lab Clin Med. 1951;38(1):1-10.
7. Kojouri K, Vesely SK, Terrell DR, George JN. Splenectomy for adult patients with idiopathic thrombocytopenic purpura: a systematic review to assess long-term platelet count responses, prediction of response, and surgical complications. Blood. 2004;104(9):2623-2634.
8. Olsson B, Andersson PO, Jernås M, et al. T-cell-mediated cytotoxicity toward platelets in chronic idiopathic thrombocytopenic purpura. Nat Med. 2003;9(9):1123-1124. doi:10.1038/nm921
9. Frederiksen H, Ghanima W. Response of first line treatment with corticosteroids in a population-based cohort of adults with primary immune thrombocytopenia. Eur J Intern Med. 2017;37:e23-e25. doi:10.1016/j.ejim.2016.09.001

Un comentario
Espero tu pronta recuperación . Que en esta situación emocional hayas escrito este articulo dice mucho de una persona , la cual pone el conocimiento y su experiencia para que los demás aprendamos. La conclusión del articulo bajo el título “Dios no juega a los dados o si” es de las mejores líneas que he leído en tiempo por su capacidad de hacerte reflexionar. Gracias por compartir conocimiento y experiencia.
Un fuerte abrazo y ánimo