Tradicionalmente se ha pensado que el corazón de los mamíferos tenía poca o ninguna capacidad de regenerarse. Esta creencia se basaba en la noción generalmente aceptada de que, en el corazón adulto, todos los miocitos (las células musculares del corazón) se diferenciaban de forma terminal y, por lo tanto, no podían recuperarse en el ciclo celular (1). De la misma forma, se afirmaba que el miocardio carece de una población de células madre capaces de generar nuevos miocitos (1). Según este punto de vista, los miocitos de una persona de 90 años tendrían también 90 años. En este sentido, la muerte celular sería muy poco frecuente si se quiere preservar la masa del corazón y, por lo tanto, su función.
Este paradigma cambió cuando un artículo publicado en Science descubrió que la edad de los cardiomiocitos es de media 6 años menor que la de la persona (2). Antes de continuar, creo que es interesante explicar cómo lo calcularon, ya que esta investigación llevada a cabo en el Instituto Karolinska (Estocolmo, Suecia) es un claro ejemplo de cómo la ciencia puede encontrar respuestas de forma extremadamente imaginativa. Durante la Guerra Fría, entre 1955 y 1963, se llevaron a cabo ensayos nucleares que aumentaron la concentración de carbono 14 (14C) en la atmósfera. Este 14C en reacción con el oxígeno forma CO2, el cual utilizan las plantas durante la fotosíntesis, quedando así marcadas. Como después éstas sirven de alimento para hombres y animales, la concentración de 14C en el cuerpo humano refleja la de la atmósfera en ese momento. Este 14C pasa al ADN de las células y de esta manera se utiliza como una marca de fecha de nacimiento celular. Así fue como vieron que personas que habían nacido antes de la Guerra Fría tenían cardiomiocitos que habían sido creados años después. Con base a estos resultados, crearon un modelo que predice que los cardiomiocitos se renuevan a una tasa del ~ 1% por año a la edad de 25 años y disminuye hasta un 0,45% a los 75 (Figura 1).
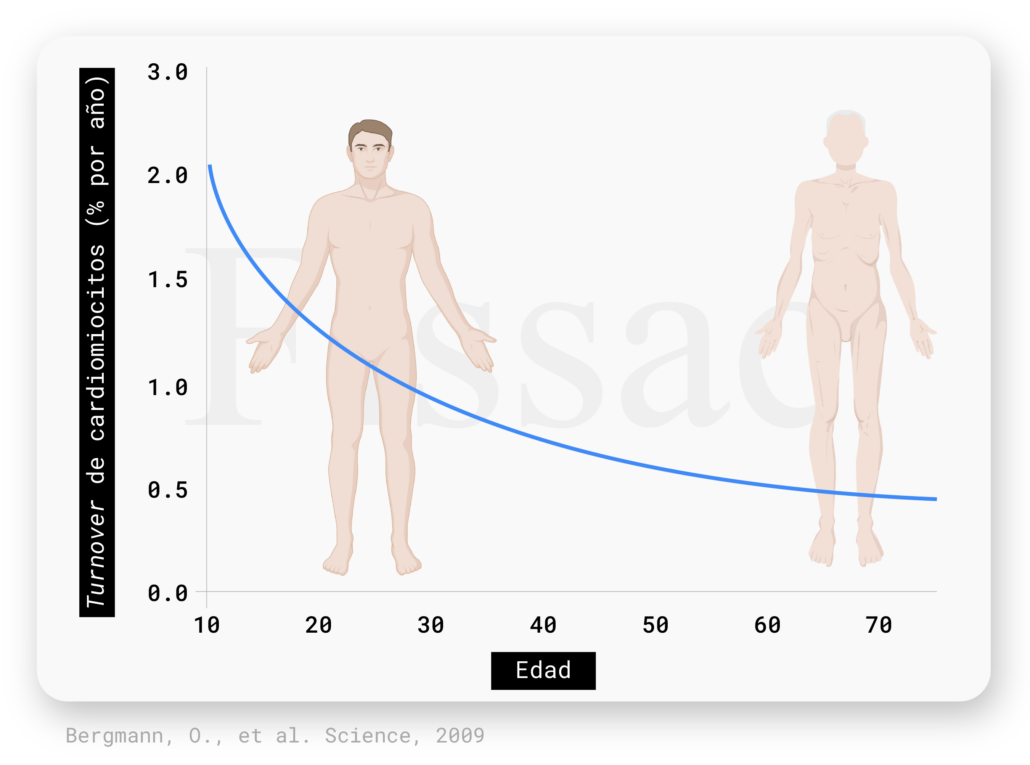
Por lo tanto, queda demostrado que nuestro corazón no crece únicamente por el aumento del volumen de las células cardiacas (hipertrofia), sino también por la regeneración de nuevas células a lo largo de nuestra vida. La renovación de los cardiomiocitos no solo es posible, sino que parece ser necesaria para mantener la homeostasis de este órgano (3). Además, el descubrimiento de las células madre cardíacas residentes en el corazón ha contribuido en gran medida a una nueva visión de la biología cardíaca (4).
Suscríbete para disfrutar de todo el contenido.
Regálate Fissac
con un 40% el primer año
Aprovecha un 40% de descuento el primer año. En lugar de 59,99€, pagas 35,99€ (3€/mes). Regálate ciencia.
Sumérgete en la profundidad de Fissac y disfruta de todo lo que tenemos para ofrecerte. Suscríbete ahora y aprende con rigor científico con los audio-artículos, webinars, masterclass y Fissac Magazine
Cancela tu suscripción cuando quieras sin compromiso. Oferta para una suscripción anual de Fissac; solo disponible para nuevos suscriptores. Para una suscripción mensual, se cobrará automáticamente por adelantado a su método de pago la tarifa de 6,00€ cada mes. Para una suscripción anual, se cobrará automáticamente por adelantado a su método de pago la tarifa introductoria de 35,99€ el primer año y 59,99€ el resto. Su suscripción continuará hasta que la cancele. La cancelación entra en vigencia al final de su período de facturación actual. Impuestos incluidos en el precio de la suscripción. Los términos de la oferta están sujetos a cambios.
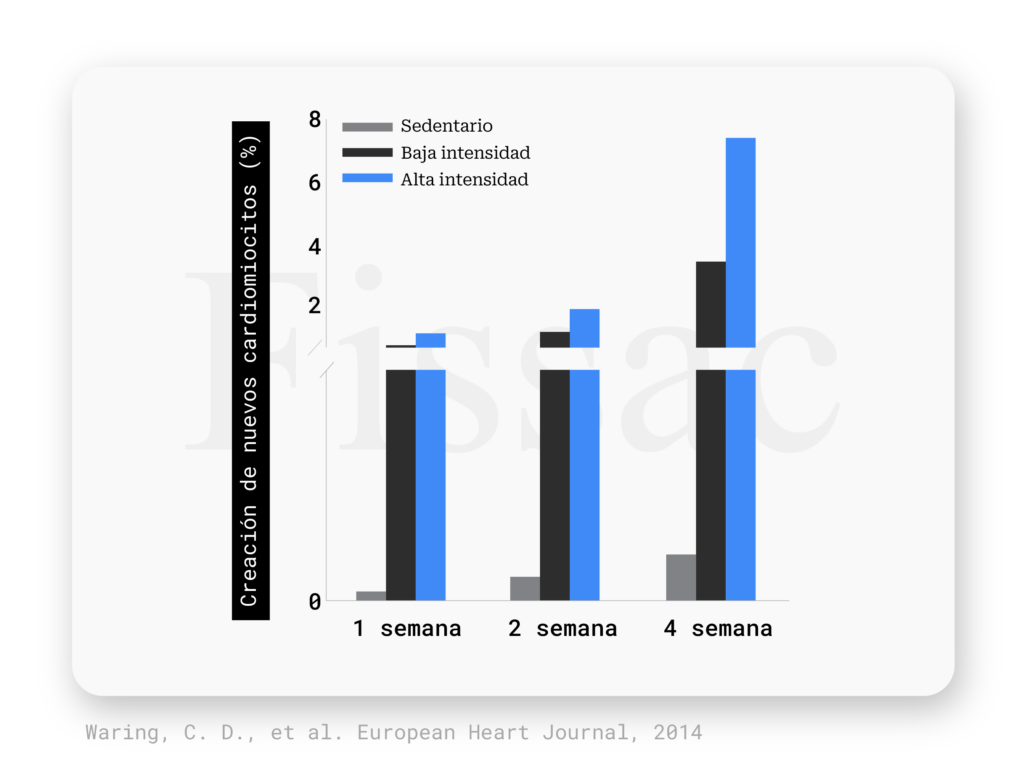
En base a ello, el ejercicio se propone como un “moldeador” del corazón, ya que es capaz de inducir una ‘hipertrofia fisiológica’ (buena) que hace que sea más fuerte y eficiente, además de inducir la creación de nuevos cardiomiocitos que permiten una renovación celular más alta. Por ejemplo, en un estudio en ratas (5), un protocolo de ejercicio aeróbico creó en tan solo 4 semanas hasta un 7% de nuevas células cardiacas. Esta cardiomiogénesis vino acompañada de la creación de nuevos vasos sanguíneos en el corazón, lo que sugiere que el aumento del flujo sanguíneo por el ejercicio podría ser uno de los principales mecanismos implicados. Uno de los aspectos más importantes es que cuanto mayor fue la intensidad del ejercicio (85-90% del consumo máximo de oxígeno), mayores beneficios se encontraron (Figura 2). El entrenamiento de alta intensidad consiguió crear un ~7% de nuevos cardiomiocitos frente al 4% del entrenamiento de baja intensidad. Por otro lado, el ejercicio intenso aumentó el número y la diferenciación de células madre del corazón, lo que también explica cómo el ejercicio aumenta las tasas de renovación cardiaca. Así, la intensidad se relacionó con una mayor capacidad de regeneración del corazón.
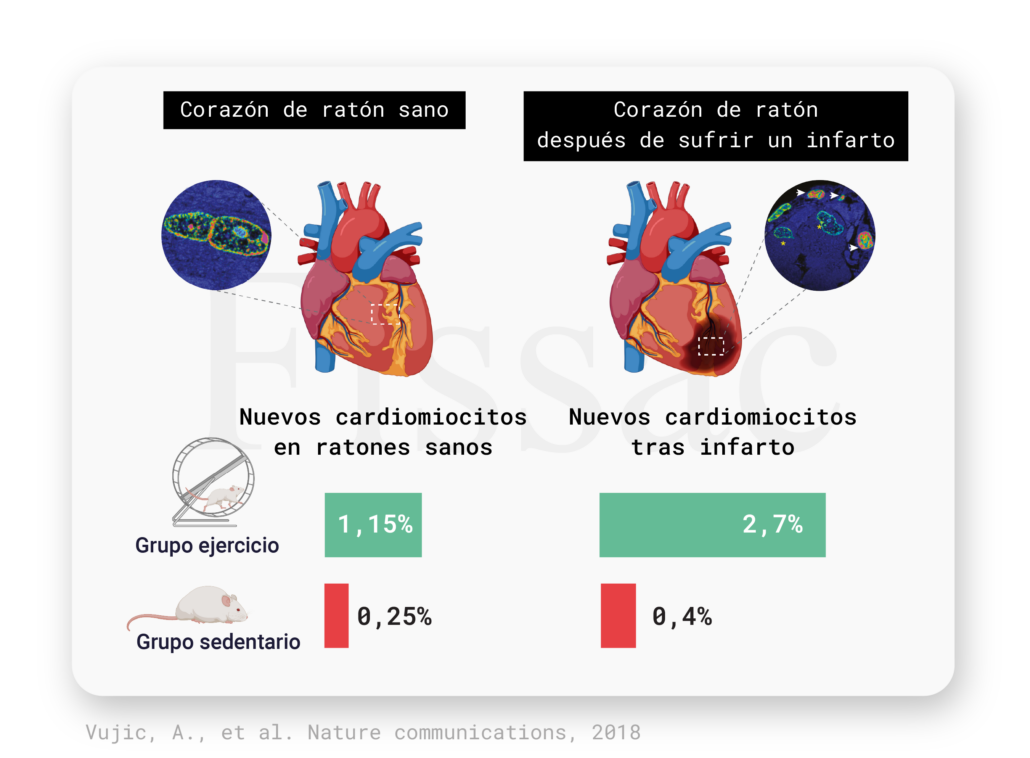
En otro estudio (6), esta vez en ratones, el ejercicio aumentó el desarrollo de nuevos cardiomiocitos (1,15% en los que hicieron ejercicio vs 0,25% en los sedentarios). Esta tasa de creación de nuevos cardiomiocitos fue mayor incluso en ratones que habían sufrido un infarto (Figura 3). Los investigadores estimaron que el ejercicio sería capaz de crear nuevos cardiomiocitos a una tasa anual de 7.5% frente al 1.63% en condiciones sedentarias. Si recordamos la proyección hecha en el artículo de Science en humanos, el turnover de células cardiacas era del 1%. ¿Podría el ejercicio incrementar ese dato en humanos? A pesar de que los estudios presentados se han hecho en animales, las bases fisiológicas sobre las que se sustentan son compartidas entre especies, lo que nos sugiere que las personas que hacen ejercicio pueden tener una mayor tasa de renovación cardiaca.
El hecho de que unas pocas semanas de ejercicio intenso puedan aumentar significativamente el número de miocitos indica que este fenómeno no es solo una curiosidad biológica sino un componente importante de la fisiología cardíaca. La respuesta miocárdica no depende tanto del tipo de ejercicio aplicado, sino más bien de la intensidad a la que se realiza (5). El ejercicio, como modelo de estrés, ofrece una serie de respuestas integradas que, en su dosis adecuada, pueden mejorar el estatus fisiológico de muchos tejidos y órganos. Como hemos visto, el envejecimiento es universal e inevitable. Lo que no lo es, es la velocidad a la que lo hacemos.
Referencias:
1. Bernardo N-G, Jan K, Annarosa L, Piero A. Myocyte Death, Growth, and Regeneration in Cardiac Hypertrophy and Failure. Circ Res [Internet]. 2003 Feb 7;92(2):139–50. Available from: https://doi.org/10.1161/01.RES.0000053618.86362.DF
2. Bergmann O, Bhardwaj RD, Bernard S, Zdunek S, Barnabé-Heider F, Walsh S, et al. Evidence for Cardiomyocyte Renewal in Humans. Science (80- ) [Internet]. 2009 Apr 3;324(5923):98 LP – 102. Available from: http://science.sciencemag.org/content/324/5923/98.abstract
3. Ellison GM, Torella D, Karakikes I, Nadal-Ginard B. Myocyte death and renewal: modern concepts of cardiac cellular homeostasis. Nat Clin Pract Cardiovasc Med [Internet]. 2007;4(1):S52–9. Available from: https://doi.org/10.1038/ncpcardio0773
4. Torella D, Ellison GM, Karakikes I, Nadal-Ginard B. Resident cardiac stem cells. Cell Mol Life Sci. 2007;64(6):661–73.
5. Waring CD, Vicinanza C, Papalamprou A, Smith AJ, Purushothaman S, Goldspink DF, et al. The adult heart responds to increased workload with physiologic hypertrophy, cardiac stem cell activation, and new myocyte formation. Eur Heart J [Internet]. 2012 Oct 25;35(39):2722–31. Available from: https://doi.org/10.1093/eurheartj/ehs338
6. Vujic A, Lerchenmüller C, Wu T-D, Guillermier C, Rabolli CP, Gonzalez E, et al. Exercise induces new cardiomyocyte generation in the adult mammalian heart. Nat Commun [Internet]. 2018;9(1):1659. Available from: https://doi.org/10.1038/s41467-018-04083-1

